Электроотрицательность измеряет тенденцию атома притягивать связующую пару электронов. Исследуйте электроотрицательность и ее тенденции среди групп и периодов периодической таблицы и узнайте, почему некоторые элементы более электроотрицательны, чем другие.
Когда вы слышите слово "связь", что приходит на ум? Может быть, вы подумываете о том, чтобы провести время со своей семьей или сходить на бейсбольный матч со своими приятелями. Теперь вспомните то время, когда вы были ребенком, и вы сблизились со своими друзьями. В этом возрасте вас, вероятно, учили делиться своими игрушками, и у некоторых из вас, возможно, получалось делиться лучше, чем у других. Атомы ничем не отличаются.
Электроотрицательность
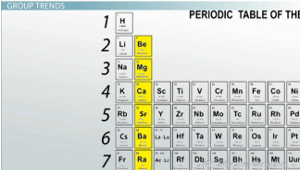
По мере продвижения вниз по группе атомный радиус увеличивается. Группа 2 Щелочноземельные металлы
Когда атомы соединяются друг с другом, образуя молекулы, они делятся своими электронами. Это совместное использование электронов - это действительно то, что создает связь. Точно так же, как дети неравномерно делятся игрушками, некоторые атомы будут лучше делиться электронами, чем другие. Некоторые полностью отдадут свои электроны, некоторые поделятся поровну, а некоторые не столько поделятся, сколько вместо этого полностью заберут электроны других атомов. Это неравномерное распределение электронов в связи происходит из-за различий в электроотрицательности.
Электроотрицательность - это способность атома притягивать другие электроны. Атомы, обладающие высокой электроотрицательностью, будут притягивать больше электронов и могут даже красть их у других атомов. Атомы с низкой электроотрицательностью будут делиться большей частью, иногда до такой степени, что потеряют свои собственные электроны. Постарайтесь запомнить это таким образом: Возможно, вы не хотели играть с ребенком, который взял ваши игрушки, потому что это вызвало негативное чувство потери чего-то, что вам нравилось. В "atom speak" у этих детей очень высокая электроотрицательность. Итак, что же делает один атом более электроотрицательным, чем другой? Ответ кроется в его атомной структуре (конечно), и точно так же, как и некоторые другие свойства элементов, периодическая таблица имеет отчетливые тенденции в электроотрицательности.
Групповые тенденции
Просто для ознакомления, группы в периодической таблице - это просто столбцы. Давайте сравним атомы в группе 2: щелочноземельные металлы. Когда вы переходите от бериллия к радию, что происходит с размером атома? Что ж, атомный радиус увеличивается по мере продвижения вниз по группе из-за увеличения числа и размера энергетических уровней, поэтому валентные электроны в каждом атоме удаляются все дальше и дальше от ядра. Ядро оказывает значительное влияние на притягивание этих отрицательных электронов своим положительным зарядом.
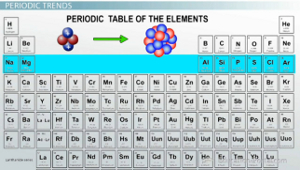
Электроотрицательность возрастает по мере прохождения определенного периода.
Итак, какие атомы, по вашему мнению, легче притянут электроны? Атомы, которые крошечные и имеют валентные оболочки близко к ядру, или атомы, которые большие и имеют валентные оболочки на большом расстоянии от ядра? Что ж, чем ближе к ядру могут подойти электроны, тем большее притяжение будет у этого ядра, поэтому атомы меньшего размера будут притягивать электроны намного легче, чем атомы большего размера.
Если вы когда-либо держали два магнита так, чтобы северный конец одного был обращен к южному концу другого, вы, возможно, чувствовали это притяжение. Чем ближе становились два магнита, тем сильнее было их притяжение друг к другу. Возможно, вам пришлось задействовать некоторые мышцы только для того, чтобы держать их раздвинутыми. Однако, когда вы отодвинули их друг от друга, вы перестали чувствовать то притяжение, которое они испытывали друг к другу.
То же самое относится к протонам и электронам. Да, они притягиваются, но чем дальше и дальше вы удаляетесь от ядра, тем меньше это притяжение. Итак, по мере продвижения вниз по группе периодической таблицы электроотрицательность уменьшается, и атомам становится труднее притягивать электроны.
Периодические тенденции
Далее мы собираемся сравнить электроотрицательности элементов за один и тот же период. Точка - это строка в периодической таблице. При перемещении по строке вы обнаружите аналогичную тенденцию электроотрицательности, как и при переходе вниз по столбцу. Меньшие атомы будут обладать большей электроотрицательностью. Имейте в виду, что при перемещении по таблице количество энергетических уровней, на которых находятся электроны, останется неизменным, поэтому все валентные электроны будут находиться на одном и том же энергетическом уровне. Однако количество протонов увеличивается по мере того, как вы перемещаетесь по столу. Это не только уменьшает размер атома (притягивая электроны, которые у него есть), но и притягивает электроны от атомов, связанных с ним.
Итак, по мере того, как вы переходите через период в периодической таблице, электроотрицательность увеличивается, и атомы имеют тенденцию притягивать электроны. Однако есть одно важное исключение. Помните электронные конфигурации благородные газы в крайнем правом углу таблицы? Их электронные конфигурации полностью заполнены - гелий имеет полную s-орбиталь, неон и аргон имеют полные s- и p-орбитали и так далее. Поскольку у этих элементов есть атомы с полными электронными оболочками, им больше не нужны электроны, да они и не хотят этого. Если бы благородный газ получил еще один электрон, ему пришлось бы открыть целый дополнительный энергетический уровень только для этого одного электрона, что сделало бы его чрезвычайно нестабильным, а в химии все меняется от нестабильного к стабильному, редко наоборот. Это сделало бы фтор самым электроотрицательным элементом в периодической таблице.
Краткое содержание урока
Помните, периодические тренды - это всего лишь тренды. Здесь и там есть некоторые различия, но помимо знания того, что благородные газы "нарушают правила" электроотрицательности, не беспокойтесь о запоминании исключений. Не стесняйтесь объяснять, что такое групповые и периодические тенденции, а также причину, по которой они существуют. Итак, по мере продвижения вниз по группе периодической таблицы электроотрицательность элемента уменьшается, потому что увеличение числа энергетических уровней уводит внешние электроны очень далеко от притяжения ядра. Электроотрицательность увеличивается по мере перемещения слева направо по периоду периодической таблицы. Это происходит потому, что, несмотря на одинаковое количество энергетических уровней, в ядре больше положительных протонов, что создает более сильное притяжение отрицательных электронов во внешней оболочке.