В периодической таблице элементы основной группы находятся в группах 1, 2 и 13-18, в то время как переходные металлы находятся в группах 3-12. Узнайте о свойствах переходных металлов, элементах основной группы таблицы Менделеева, а также о том, как сравнивать характеристики переходных металлов с элементами основной группы.
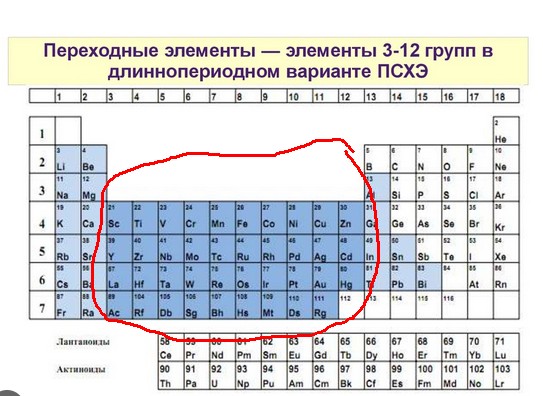
Переходные металлы находятся в группах с 3 по 12 периодической таблицы Менделеева.
Вы можете поблагодарить основные элементы группы за многое. Это основные элементы, содержащиеся в живых организмах (то есть в вас). Они составляют большую часть Земли, Солнечной системы и даже Вселенной! И они играют важную роль в промышленности и экономике. Итак, что же это за элементы и каковы некоторые из их особенностей?
Точно так же, как местоположения на карте, разные области периодической таблицы содержат элементы с разными характеристиками. В этом уроке мы собираемся сравнить и противопоставить две самые большие области периодической таблицы: элементы основной группы и переходные металлы. Оба этих крупных региона обладают различными особенностями и качествами, но прежде чем мы перейдем к их характеристикам, давайте расположим эти регионы в таблице. Во-первых, элементы основной группы состоят из первых двух столбцов (столбцы водорода и бериллия) и последних шести столбцов (столбцы бора и гелия). Используя правильную терминологию периодической таблицы, мы бы сказали, что это элементы, встречающиеся в группах 1, 2 и с 13 по 18. Переходные металлы находятся в группах с 3 по 12. Вы можете заметить, что мы опускаем этот "остров" элементов внизу. Верхний ряд этого островка составляют лантаноиды, а нижний ряд - актиноиды. Мы опускаем их, потому что они не являются ни элементами основной группы, ни переходными металлами.
Основные элементы группы
Элементы основной группы, безусловно, являются наиболее распространенными элементами - не только на Земле, но и во всей Вселенной. По этой причине их иногда называют "репрезентативными элементами". Элементы основной группы находятся в s- и p-блоках, что означает, что их электронные конфигурации заканчиваются на s или p. Помните, что s- и p-блоки отвечают за обеспечение валентных электронов, тех сверхважных электронов, которые участвуют в химической связи. Как электронные конфигурации, так и количество валентных электронов очень предсказуемы по мере того, как мы переходим к элементам основной группы. В группе 1 есть элементы с одним валентным электроном, в группе 2 есть элементы с двумя, в группе 13 есть элементы с тремя валентными электронами и так далее до группы 18 с восемью валентными электронами.
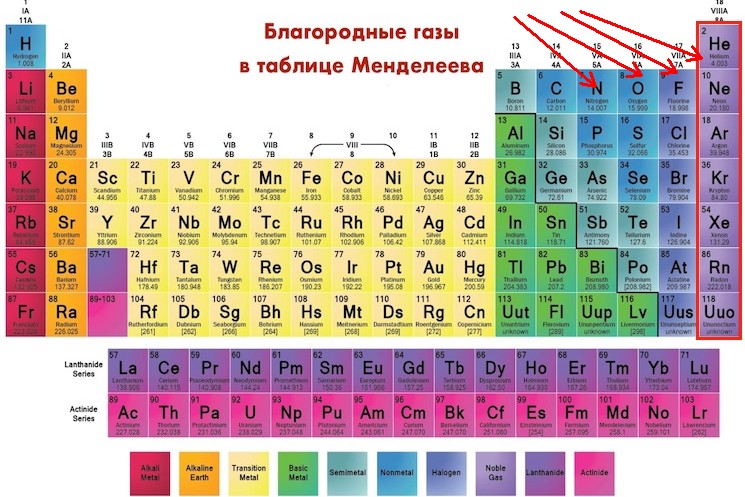
Неметаллические газы, за исключением благородных газов, имеют тенденцию приобретать электроны.
Давайте используем натрий в качестве примера того, как элементы основной группы химически предсказуемы. Натрий, имеющий один валентный электрон, почти всегда будет существовать в одной из двух форм: в его нестабильной, электрически нейтральной, металлической форме (с одним валентным электроном) или в его стабильной, положительно заряженной, ионной форме (без этого одного валентного электрона). Это оно. Всего две формы натрия. Эта предсказуемость в количестве валентных электронов создает предсказуемость в химической связи - то, за что вы будете очень благодарны позже. Кому не нравится немного последовательности в химии?
Помимо предсказуемости склеивания и их высокого содержания, эти элементы не могли бы больше отличаться друг от друга. Поскольку элементы основной группы состоят как из металлов, так и из неметаллов, их физические свойства будут совершенно разными. Например, элементы слева (в группах 1, 2 и 13) будут твердыми, очень металлическими и будут иметь тенденцию терять электроны, в то время как многие элементы справа являются неметаллическими газами, которые будут иметь тенденцию приобретать электроны. Что ж, полные оболочки благородных газов приведут к тому, что они не захотят получать электроны.
Переходные металлы
Переходные металлы получили удачное название: они обеспечивают мост, или переход, между металлами основной группы и неметаллами. Все они являются металлами, и они находятся в d-блоке, что означает, что их электронные конфигурации будут иметь незаполненные d-орбитали. Эти незаполненные d-орбитали делают элементы гораздо менее предсказуемыми и непротиворечивыми, что приводит к некоторым очень интересным свойствам.
Давайте возьмем в качестве примера chromium. Хром может принимать различные формы в зависимости от того, с чем он связан. Во-первых, он встречается в своей первоначальной, нейтральной, металлической форме. Иногда он потеряет один электрон; иногда он потеряет два; иногда три, четыре, пять или даже шесть электронов! И каждая из этих форм имеет разный цвет, варьирующийся от темно-фиолетового до ярко-желтого и ярко-красного. Переходные металлы, безусловно, являются самыми красочными и привлекательными в своих многочисленных формах.
Наконец, эти незаполненные d-орбитали переходных металлов обуславливают их многочисленные парамагнитные свойства. Как вы, возможно, знаете по опыту, скрепки обычно не магнитные; если вы возьмете одну из них, остальные в комплект не входят (если, конечно, они не соединены вместе). Однако, если вы поднесете магнит к группе скрепок, вы можете заметить, что они временно будут действовать как магнитные. Это пример парамагнетизма, который заключается в том, что внешнее магнитное поле индуцирует магнитное поле на веществе. Это индуцированное магнитное поле слабое и временное, но оно существует.
Краткое содержание урока
Так что же лучше - быть предсказуемым и последовательным или быть похожим на хамелеона, проявляющимся во множестве форм и цветов? Тебе решать! Элементы основной группы имеют отчетливые и специфические тенденции в количестве валентных электронов, что приводит к общей предсказуемости, когда дело доходит до химической связи (что-то, что пригодится позже в будущем). Они будут существовать либо как нейтральные элементы, либо как стабильные ионы, и если они действительно теряют или набирают электроны для достижения полных внешних оболочек, это будет выигрыш или потеря одного и того же количества электронов каждый раз (в зависимости от того, что необходимо для полных s- и p-оболочек). Переходные металлы, с другой стороны, могут терять различное количество электронов - если они вообще их теряют! Эти элементы с частично заполненными d-орбиталями могут демонстрировать чрезвычайно яркие цвета (в зависимости от того, в какой форме они находятся), а некоторые могут стать временными магнитами, если они окружены магнитным полем.