Электронная конфигурация — это представление о том, как устроены электроны в атоме, которое можно использовать для предсказания свойств элемента. Узнайте о закономерностях энергетических уровней элементов в периодической таблице, о том, как определить количество электронов в нейтральном атоме и как написать электронную конфигурацию для нейтральных атомов.
Электроны
На диаграмме показаны множественные электронные узоры
Как вы думаете, какая из трех субатомных частиц (протонов, нейтронов и электронов) является самой важной? Вы можете подумать, что протоны являются наиболее важными, потому что именно они определяют, к какому типу элементов относится атом. Или вы можете подумать, что нейтроны важны, потому что именно они могут сделать атомы одного и того же элемента более тяжелыми или более легкими, обнаруживаясь в большем или меньшем количестве в ядре. Но когда дело доходит до химии и химических реакций, самой важной субатомной частицей является электрон. Электроны — звезды химического шоу. Вот почему мы собираемся посвятить несколько уроков этой отрицательно заряженной, сверхскоростной, очень крошечной, неуловимой частице.
Из следующего урока вы узнаете, почему я называю электрон неуловимым. Но почему именно звезда? Химические свойства атома во многом зависят от расположения его электронов. Поэтому, прежде чем мы сможем обсудить, как можно предсказать его химические свойства, нам сначала нужно узнать, как устроены электроны в атоме.
Количество электронов
Помните, что электроны отрицательно заряжены, почти не имеют массы и расположены в электронном облаке, а это означает, что они находятся в чрезвычайно большом месте за пределами ядра. Именно они занимают все пространство в атоме, и объем занимаемого ими пространства будет зависеть от того, сколько у них энергии (подробнее об этом позже).
Во-первых, важно знать, сколько электронов имеет каждый атом. В этом уроке мы будем обсуждать только нейтральные атомы, поэтому каждый атом всегда будет иметь точно такое же количество электронов, как и протонов.
К этому моменту вы уже должны уметь определять количество протонов в атоме. Если нет, давайте сделаем быстрый обзор. Найдите олово в периодической таблице. Он находится в середине справа и имеет символ Sn. Сколько протонов у атома олова? Ответ 50, что также означает, что нейтральный атом олова будет иметь 50 электронов. Таким образом, по мере увеличения атомного номера элементов (количества протонов) у них также будет увеличиваться количество электронов. У атома водорода будет один электрон, у атома гелия — два электрона, у атома лития — три электрона и так далее.

Из диаграммы видно, что атом криптона имеет 36 электронов.
Электронные узоры
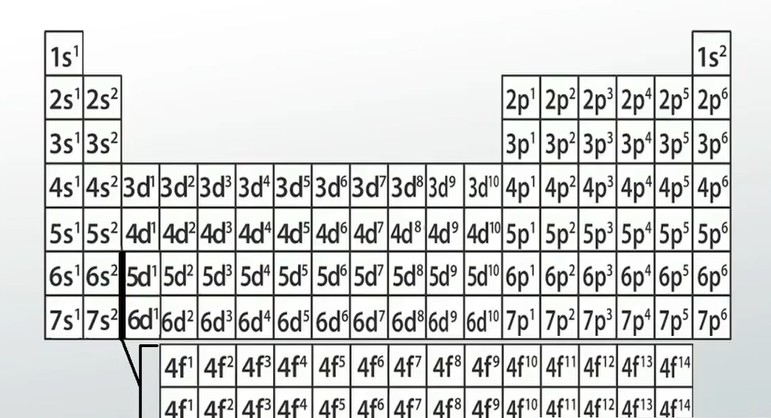
То, что заставляет атом вести себя определенным образом, не в том, сколько у него электронов, а в том, как они расположены. К счастью, расположение электронов в электронном облаке вполне предсказуемо. Давайте посмотрим на эту диаграмму.
Это может выглядеть как набор цифр и букв в блоках, расположенных как в периодической таблице, но присмотритесь. Вы видите какие-то закономерности? Во-первых, вы можете заметить, что большие числа увеличиваются по мере продвижения вниз. Это число указывает энергетический уровень электрона. Чем выше число, тем больше энергии будет у электрона! Вы также можете заметить, что в центре таблицы, в этой углубленной области, числа следуют той же схеме, но на единицу меньше, чем числа на «башенках» с обеих сторон.
Давайте посмотрим, сможем ли мы увидеть шаблон с буквами. Буквы кажутся более организованными. За исключением нескольких, все s заблокированы вместе на левой «башне», которую мы назовем s -блоком , все d находятся в утопленной центральной части, которую мы назовем d - блоком , p f находятся в правой «башне», которую мы назовем p -блоком , а все f находятся на нижнем «острове», который, как вы, возможно, догадались, называется - блоком .
Последний паттерн, который вы можете заметить, это крошечные надстрочные числа. Вы должны увидеть, что в s -блоке они увеличиваются с 1 до 2, в d -блоке они увеличиваются с 1 до 10, в p -блоке они увеличиваются с 1 до 6, а в f -блоке они увеличиваются с 1 до 14. Маленькие надстрочные индексы просто считают числа; они представляют количество электронов в каждой комбинации цифр и букв.

Электронная конфигурация атома криптона
Итак, что же все это значит? Каждая из этих маленьких групп цифр и букв представляет информацию о местонахождении электрона. Мы рассмотрим более подробно, какие виды информации в следующем уроке. А пока сосредоточьтесь на цифрах и буквах. Например, водород (в самом верхнем левом углу) имеет один электрон. Этот электрон называется 1 -секундным электроном. Гелий (в самом верхнем правом углу), обозначенный 1 s 2 , имеет два электрона. Оба они являются 1 s электронами. Литий находится в коробке с маркировкой 2 s 1 . Атом лития имеет три электрона: два 1s - электрона и 2s - электрон. Вы начинаете видеть закономерность?
Давайте попробуем более сложный вариант. Найдите алюминий в таблице Менделеева. На этой диаграмме он находится в поле с надписью 3p1. Сколько электронов у алюминия? Ну, у него 13 протонов, так что нейтральный атом алюминия должен иметь 13 электронов. Какие это электроны? Ну, у него есть два электрона 1s, два электрона 2s, шесть электронов 2p, два электрона 3s и один одинокий электрон 3p. Видите ли вы, как мы всегда начинаем с поля водорода в верхнем левом углу и двигаемся слева направо, пока не доберемся до рассматриваемого атома? Не придавайте слишком большого значения паре нижних строк и "островку" внизу. Там, внизу, все становится немного сложнее, и вам не нужно слишком беспокоиться об этих элементах.
Электронные конфигурации
Давайте попробуем еще один пример, прежде чем перейдем к следующему шагу по объединению всего этого воедино. Найдите криптон в крайнем правом углу периодической таблицы. На этой диаграмме он находится в квадрате 4p6. Какие электроны будут у атома криптона? В hydrogen мы всегда будем начинать с верхнего левого угла. Криптон имеет два 1s-электрона, два 2s-электрона, шесть 2p-электронов, два 3s-электрона, шесть 3p-электронов, два 4s-электрона, десять 3d-электронов и шесть 4p-электронов! В сумме должно получиться 36 электронов, что идеально, потому что именно столько протонов в атоме криптона!
Электронная конфигурация
Каждый атом имеет электроны в своем электронном облаке. Число электронов в электронном облаке атома является атомным номером этого элемента. Эти электроны располагаются на определенных энергетических уровнях, окружающих ядро. В этом упражнении мы собираемся использовать периодическую таблицу для определения электронной конфигурации нескольких элементов. Для этого занятия вам понадобится периодическая таблица.
Обозначение периодической таблицы
Первые два столбца в левой части периодической таблицы — это элементы s-блока. Средний отдел до группы 12 - это d-блок. Остальные группы включают элементы p-блока, за исключением гелия. Он находится в s-блоке. Мы не будем работать с f-блоком, который представляет собой две нижние строки, отделенные от двух основных групп.
Строки говорят нам, на каком энергетическом уровне находится электрон. Номер группы внутри блока говорит нам, сколько электронов находится в этой подоболочке. Мы начнем с элемента, с которым работаем, и будем двигаться в обратном направлении.
Например, электронная конфигурация лития 1s 2 2s 1 . Мы начинаем с лития в периодической таблице и видим, что он находится во второй строке и первом столбце s-блока, поэтому его электронная конфигурация заканчивается на 2s 1 . Все внутренние орбитали заполнены, что означает завершение 1s 2%. Это дает нам 2s 1 1s 2 . Изменение этого порядка на противоположное дает нам правильную электронную конфигурацию 1s 2 2s 1 .
Практика электронной конфигурации
- Напишите электронную конфигурацию бериллия.
- Напишите электронную конфигурацию серы.
- Напишите электронную конфигурацию кальция.
Ответы
- 1s 2 2s 2
- 1s 2 2s 2 2п 6 3s 2 3п 4
- 1s 2 2s 2 2п 6 3s 2 3п 6 4s 2