Ученые по атомной теории
В Древней Греции шла интересная дискуссия: из чего состоит вопрос? Материя определяется как все, что имеет массу и занимает пространство. Последователи философа Аристотеля придерживались убеждения, что материя может быть разделена на бесконечность, никогда не достигая мельчайшего кусочка. Гипотеза Аристотеля была наиболее широко принята. Противоположная идея философа Демокрита (что мельчайшие кусочки материи существуют) вызвала шквал критического мышления, любопытства и дебатов. Демокрит использовал морковку в качестве одной из иллюстраций своей гипотезы. Он объяснил, что морковь можно разрезать пополам, затем снова разрезать пополам, и снова, непрерывно. В конце концов, оставался кусок настолько маленький, что он больше не был виден и не мог быть разрезан дальше, но все еще был морковным веществом. Демокрит называл эти мельчайшие кусочки материи атомосами, что означает неделимые.
Сегодня мы знаем, что Демокрит был прав, и его слово атомос — это то, где мы получаем наши слова атомы. Атом определяется как наименьший кусочек идентифицируемой материи. Различные типы материи состоят из разных типов атомов. Сам атом состоит из более мелких частей (протонов, нейтронов, электронов), и эти части состоят из частей (кварков и глюонов), и если эти части также могут быть разбиты на более мелкие кусочки, он еще не открыт. Однако атом является мельчайшим кусочком материи, который может быть идентифицирован как конкретная материя. Возьмем, к примеру, атом углерода. Если атом углерода разделен на свои протоны, нейтроны и электроны, он больше не идентифицируется как углерод. Вся материя, состоящая только из одного типа атома, является элементом. Чистое золото, например, является элементом: оно полностью состоит из атомов золота. Все известные в настоящее время атомы/элементы перечислены в Периодической таблице элементов. Почему атомная теория важна? Цель атомной теории — понять, что такое материя и как она себя ведет. Мы используем эти характеристики материи для манипулирования и контроля над ней для разработки новых лекарств, технологий, транспортных средств, структур и оружия.
Демокрит не открывал атомов, он просто теоретизировал их существование. Итак, когда же были обнаружены атомы? В 1800-х годах Джон Далтон, английский химик, физик и метеоролог, провел серию экспериментов, которые поддержали атомную теорию Демокрита и предложили нашу первую модель атома. Позже в том же столетии эксперименты английского физика Дж.Дж. Томсона
показали, что атомы состоят из еще более мелких частиц, которые заряжены, и пересмотрели модель Дальтона. Эксперименты в начале 1900-х годов Эрнеста Резерфорда, новозеландско-британского физика, подтвердили вывод о том, что атомы имеют две части, с большей частью их массы в центре, или ядре, и более мелкие частицы дальше с пустыми пространствами между ними. Нильс Бор, датский физик, провел исследования в 1913 году, которые привели к открытию атомов, имеющих движущиеся части вокруг ядра на отдельных, отдельных орбиталях. Роберт Милликен, американский физик, получил Нобелевскую премию в 1921 году за открытие того, как измерить заряд электронов. Самая последняя модель атома была получена от австрийско-ирландского физика Ирвина Шредингера в 1926 году.
Историческое развитие атомной теории
Чего достигла ранняя атомная теория? С 1800-х годов ученые представили модели, которые обеспечили лучшее понимание атома. Их модели помогают объяснить, что такое атомы, как они выглядят и как они себя ведут. Дальтон предположил, что атомы являются твердыми сферами. Модель сливового пудинга Томсона также была сферической, но с видимыми, отчетливыми и
заряженными частями, равномерно распределенными по всей длине. Ядерная модель Резерфорда показала атомы с ядерным центром и другие частицы, случайно вращающиеся на расстоянии. Бор модифицировал ядерную модель Резерфорда своей планетарной моделью, предположив, что электроны имеют более специфическую, регулярную планетоподобную орбиту. Роберт Милликен провел эксперименты, которые привели к возможности измерения заряда электрона. Модель квантового электронного облака Шредингера является самой современной моделью на сегодняшний день. Он предположил, что вместо того, чтобы двигаться по прямым путям, электроны появляются случайным образом в пределах определенных энергетических уровней.
Атомная модель Дальтона
Джону Далтону приписывают разработку первой атомной модели, известной как модель твердой сферы, в 1803 году. Он провел серию экспериментов с газами и давлением. Он сжимал различные газы в закрытых контейнерах, и его результаты подтверждали теорию о том, что газы - это материя, состоящая из крошечных круглых частиц (атомов), и что разные газы были сделаны из разных типов атомов. Эксперименты Дальтона показали, что атомы действительно существуют. Его теория включала идею о том, что атомы не могут быть уменьшены и не могут быть уничтожены. Его теория также утверждала, что все атомы в чистых элементах идентичны друг другу и что разные элементы имеют свои собственные, уникальные атомы. Чтобы получить различные типы материи, которые не являются чистыми элементами, Дальтон предположил, что атомы разных элементов объединяются, образуя различные соединения. Несмотря на то, что Дальтон не мог физически видеть атомы, он продемонстрировал их существование и то, что они специфичны для элементов!
Модель Дальтона представляла собой сплошную сферу.
Как Томсон помог нашему пониманию атома?
Томсон помог нам понять атом, обнаружив существование электронов в 1897 году. Его результаты показали, что Дальтон ошибался в том, что атом является твердой сферой, не имея меньших частей. Томсон использовал стеклянный вакуумный инструмент, называемый электронно-лучевой трубкой. Посылая электричество через электронно-лучевую трубку, Томсон показал, что полученный луч света состоит из чрезвычайно крошечных, отрицательно заряженных частиц. Эти частицы были настолько малы, что они были близки к тому, чтобы быть в 2 раз легче, чем атом водорода (самый маленький из известных)! Томсон правильно заключил, что эти частицы должны быть кусочками внутри атомов. Он также предположил, что эти отрицательно заряженные куски должны быть окружены положительно заряженным веществом, чтобы оставаться нетронутыми и стабильными.
Эти результаты привели Томсона к гипотезе, что атом может напоминать полутвердую, положительно заряженную сферу с равномерно диспергированными, отрицательно заряженными электронами по всей длине. Его модель стала известна как модель сливового пудинга. Сливовый пудинг – популярный десерт в Англии. Это полутвердая сфера с изюмом, равномерно распределенным по всему телу, и ученые думали, что она напоминает модель Томсона.
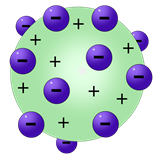
Модель пудинга Thomson Plum
Ранние греки. Во-первых, мы собираемся перенестись чуть более чем на 2000 лет назад, во времена Аристотеля и Демокрита. Греческий философ Аристотель верил, что материю можно делить бесконечно, не меняя ее свойств. Демокрит не согласился. Он думал, что материю можно разделить только до тех пор, пока вы не доберетесь до мельчайшей частицы (которую он назвал атомом, происходящим от греческого слова atomos, означающего неделимый). Итак, кто же был прав? Аристотель был очень убедителен и провел много экспериментов, используя научный метод, поэтому ему поверило больше людей.
Джон Далтон и атомы
Это произошло примерно 2000 лет спустя, в начале 1800-х годов, когда появился Джон Далтон и опроверг Аристотеля. Далее Далтон сказал, что материя состоит из крошечных частиц, называемых атомами, которые не могут быть разделены на более мелкие кусочки и не могут быть уничтожены. Он также заявил, что все атомы одного и того же элемента будут совершенно одинаковыми и что атомы разных элементов могут объединяться, образуя соединения. Действительно удивительная вещь в модели атома Далтона заключается в том, что он придумал ее, даже не видя атома! У него не было понятия о протонах, нейтронах или электронах. Его модель была создана исключительно на основе экспериментов, которые были макроскопическими или видимыми невооруженным глазом.
Томсон и открытие электронов
Теперь давайте перенесемся в конец 1800-х годов, когда Дж.Дж. Томсон открыл электрон. Томсон использовал то, что называлось электронно-лучевой трубкой, или электронной пушкой. Вы, вероятно, видели электронно-лучевую трубку, даже не подозревая об этом! Они представляют собой громоздкую электронную часть старых телевизоров. Томсон использовал электронно-лучевую трубку с магнитом и обнаружил, что создаваемый ею зеленый луч состоит из отрицательно заряженного материала. Он провел множество экспериментов и обнаружил, что масса одной из этих частиц почти в 2000 раз легче атома водорода. Исходя из этого, он решил, что эти частицы, должно быть, пришли откуда-то изнутри атома и что Дальтон был неправ, утверждая, что атомы нельзя разделить на более мелкие части. Томсон пошел еще дальше и определил, что эти отрицательно заряженные электроны нуждаются в чем-то положительном, чтобы уравновесить их. Итак, он определил, что они были окружены положительно заряженным материалом. Это стало известно как модель атома "сливовый пудинг". Отрицательно заряженные сливы были окружены положительно заряженным пудингом.
Резерфорд и ядро
Несколько лет спустя Эрнест Резерфорд, один из студентов Томсона, провел несколько тестов на модели томсоновского сливового пудинга. Сотрудники его лаборатории направили пучок положительно заряженных частиц, называемых альфа-частицами, на очень тонкий лист золотой фольги. (Позже вы узнаете, что альфа-частицы на самом деле являются просто ядрами атомов гелия.) Поскольку эти альфа-частицы имели такую большую массу, он полностью ожидал, что все альфа-частицы пройдут прямо через золотую фольгу. Это потому, что, если бы Томсон был прав относительно модели атома в виде сливового пудинга, альфа-частицы просто прошли бы через положительно заряженную материю и попали бы на экран обнаружения с другой стороны.
Милликен и заряд электрона
Наконец, мы продвинемся еще на несколько лет вперед, когда Роберт Милликен откроет заряд электрона. Он сделал это, используя свой знаменитый "эксперимент с каплями масла", в ходе которого он распылял заряженные капли масла между двумя металлическими пластинами. Он смог предотвратить выпадение масляного тумана, уравновесив направленную вниз гравитационную силу электрической силой, равной заряду капли масла, что заставило каплю масла отталкиваться вверх. Когда эти две противоположные силы уравновесились, он смог рассчитать заряд капли масла и с помощью графика определить, сколько заряженных частиц находится в каждой капле; затем вычислите заряд каждой отдельной частицы.
Краткое содержание урока
Это были лишь немногие из сотен ученых, которые упорно трудились, чтобы расширить наши знания и понимание атома. Важно отметить, что наше понимание было эволюционным процессом, включая противоположные взгляды Аристотеля и Демокрита на атом - Аристотель верил, что материя может быть разделена навсегда, а Демокрит верил, что мы в конечном итоге доберемся до мельчайшей частицы, называемой атомом. Две тысячи лет спустя Дальтон доказал, что Демокрит был прав. Вскоре после этого электроны были открыты Томсоном, ядро - Резерфордом, а заряд электрона был измерен Милликеном. Картина атома, которая была у вас в начале этого урока, все еще несовершенна по сравнению с текущим представлением об атоме, которое мы обсудим на следующем уроке. И по мере того, как ученые раскрывают все больше деталей об атоме, модель, которую мы используем для его описания, будет меняться и становиться все более точной.